Ammoniak bruges til kunstgødning
Bliv klogere på hvordan ammoniak holder liv i halvdelen af verdens befolkning.

Anlæg til fremstilling af kunstgødning med ammoniak. Foto: Colourbox.
Ammoniakmolekyle (blå=N, hvid=H)
Ammoniak (NH3) er et stof, som de fleste har hørt om og kender til. Vi kender det som et kemikalie fra kemiundervisningen, som en bestanddel af urinstof (NH2)2CO eller som en af komponenterne i salmiak NH4Cl. Men faktisk er hovedanvendelsen af ammoniak fremstillingen af kunstgødning.
Næsten alle typer kunstgødning indeholder en masse ammoniak, da planterne har brug for ammoniak til at gro. Blandt andet indgår ammoniak som en del af de aminosyrer, som alle proteinerne er opbygget af. De fleste planter kan ikke selv danne ammoniak i tilstrækkelige mængder, så derfor skal det tilføres i form af gylle eller via kunstgødning.
Reaktionsligningen for ammoniak-reaktionen ses her:
N2 (g) + 3H2 (g) –› 2NH3 (g)
Ammoniak fremstilles kemisk ved en reaktion mellem dinitrogen (kvælstof – N2) og dihydrogen (brint – H2). Det er dog en meget vanskelig reaktion at få til at forløbe, da den meget stærke trippel-binding mellem nitrogenatomerne i dinitrogen skal brydes. Og det var først så sent som i 1908, at processen blev udviklet og patenteret af den tyske kemiker Fritz Haber. Haber solgte derefter rettighederne til det tyske kemikaliefirma BASF, hvor Carl Bosch og hans medarbejdere udviklede processen og opskalerede den til at kunne køre i industriel skala. Derfor kaldes processen også for Haber-Bosch-processen i daglig tale.

Indisk ammoniak-anlæg, der kan producere 3000 tons ammoniak om dagen.
I 1913 startede det første industrielle anlæg til fremstilling af ammoniak i nærheden af Mannheim i Tyskland. Anlægget kunne producere 11.000 tons ammoniak pr. år. Efterspørgslen var dog meget højere, og inden for kort tid blev der bygget en masse anlæg, så man allerede i 1937 producerede 755.000 tons ammoniak pr. år på verdensbasis.
Derfra gik det kun opad. Nu til dags produceres der omkring 150.000.000 tons ammoniak pr. år på de cirka 650 fabrikker, der ligger rundt omkring i verden. Ammoniak er på vægtbasis det stof, der produceres næstmest af i verden, kun overgået af svovlsyre (~180 mio. tons pr. år), der sjovt nok også bruges i produktionen af kunstgødning – nemlig til at opløse calciumfosfat Ca(PO4)3.
Indtil begyndelsen af 1900-tallet fandtes der ingen kunstgødning, og dermed var udbyttet fra landbrugsmarker ikke specielt højt. Der var altså en grænse for, hvor mange mennesker man kunne brødføde. Men med indførelsen af kunstgødningen er det blevet muligt at få et meget større udbytte pr. hektar landbrugsareal, hvilket har gjort det muligt at brødføde verdens stadigt voksende befolkning.
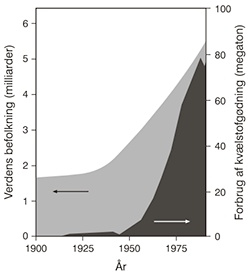
Sammenhæng mellem verdens befolkningstal og forbruget af kunstgødning. Klik på billedet for at se det større.
I figuren ser vi sammenhængen mellem forbruget af kunstgødning og verdens befolkning. Som det fremgår, var befolkningstallet forholdsvis stabilt på lidt under to milliarder mennesker, indtil man i 1940’erne for alvor fik gang i produktionen af kunstgødning. Sidenhen er befolkningstallet steget til over 6 milliarder mennesker. Antager vi, at vores planet uden kunstgødning kun kan brødføde de 2 milliarder mennesker, som figuren indikerer, så betyder det, at 4 milliarder mennesker i dag holdes i live, udelukkende fordi vi kan lave ammoniak og kunstgødning. Altså at 4 milliarder mennesker lever, fordi Haber og Bosch udviklede af ammoniakprocessen.
En mere præcis beregning af landbrugsudbytter, kapaciteter og befolkningstallet foretaget af FAO (FN’s landbrugsorganisation) viser, at et mere korrekt estimat er, at 3 milliarder mennesker holdes i live på grund af kunstgødning, hvilket stadig er et imponerende tal.
En ammoniakfabrik består af en lang række processer, hvoraf reaktionen mellem dinitrogen og dihydrogen kun er én af mange. Dinitrogen fås fra luften, som består af omkring 78 % N2. Dihydrogen kan man ikke finde i naturen, så det fremstilles på ammoniakfabrikken ud fra naturgas. Naturgas består for det meste af CH4, og med det som eksempel sker følgende reaktioner:
De to reaktioner benævnes normalt steam reforming og water gas shift. I de fleste anlæg kører steam reformingen i to trin:
Ligeledes foregår water gas shift i to trin ved henholdsvis ~350°C og ~220°C. Efter denne behandling har gassen typisk følgende sammensætning:
| Dihydrogen H2 | 74,3 % |
| Dinitrogen N2 | 24,8 % |
| Argon Ar* | 0,2 % |
| Naturgas/methan CH4 | 0,7 % |
*Ar (og andre ædelgasser) stammer fra den atmosfæriske luft, som bruges som kilde til N2.
Bemærk at volumenforholdet (og dermed molforholdet) mellem dihydrogen og dinitrogen er tæt på 3, hvilket er det støkiometriske forhold i ammoniakreaktionen.
Det koster en del energi af fremstille ammoniak. Det gør det blandt andet, fordi ammoniakreaktionen foregår ved højt tryk (150-250 bar) og ved høj temperatur (300-550°C). Men endnu mere energi bruges til fremstillingen af dihydrogen, specielt fordi steam reforming er en endoterm (varmeforbrugende) reaktion, hvorimod water gas shift er tilnærmelsesvis varmeneutral, og ammoniakreaktionen selv er en exoterm (varmeproducerende) reaktion.
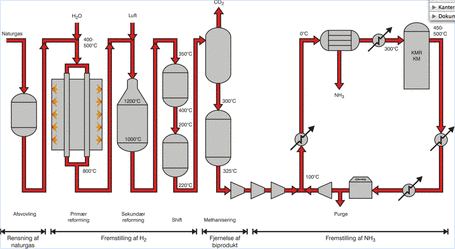
Skitse af typisk ammoniak-anlæg.
Styringen af energiproduktion/forbrug i et ammoniakanlæg og energieffektiviteten i de forskellige processer har altså stor indflydelse på, hvor meget energi der samlet bruges til at fremstille ammoniak. Og det er en vigtig faktor i verdens samlede energiforbrug, fordi der produceres så store mængder af ammoniak. Rent faktisk går mere end 1 % af verdens samlede energiforbrug udelukkende til at lave ammoniak. Opgaven med at opnå så høj energieffektivitet som muligt er derfor en af de store ingeniørmæssige udfordringer inden for industriel produktion af ammoniak.
Det danske firma Haldor Topsøe er en af de førende firmaer inden for ammoniakteknologi i verden og har været med til at indføre banebrydende nye måder at fremstille ammoniak på. Blandt andet ved hjælp af Haldor Topsøes teknologier er det lykkedes næsten at halvere energiforbruget i ammoniakfremstillingen fra 50 GJ (50.000.000.000 J) pr. tons ammoniak i 1960 til nu under 30 GJ pr. tons ammoniak. Den nedsættelse af energiforbruget har ikke blot sparet en masse energi, men også betydet en stor besparelse i udledningen af CO2 pr. tons ammoniak, der er blevet produceret. Det ser vi på i den følgende opgave.
Brug energien effektivt
– Hvad er LED lys?
– Køb LED pærer med omtanke
– Ammoniak bruges til kunstgødning (denne side)
— Opgave om kunstgødning
Denne artikel stammer oprindeligt fra Climate Minds, som er udviklet af Experimentarium i samarbejde med Dansk Energi og Energyminds.
Skrevet af Forskningskemiker, Kim Johannsen, Haldor Topsøe 8. maj 2010
TIlmeld dig Experimentariums nyhedsbrev og få forunderlig videnskab og tips til sjove eksperimenter, I kan lave derhjemme.
Du modtager nu vores nyhedsbrev. Vi glæder os til at fortælle dig nyt inden længe.
Indtast din e-mail
Vælg en nyhedsbrevsliste
Prøv venligst igen
Den e-mail du indtastede ser ud til at have en fejl. Indtast venligst en korrekt e-mail adresse.
e-mail du indtastede er allerede på vores mailliste. Tjek din e-post en ekstra gang.
Vi skal bede dig acceptere betingelserne for at modtage vores nyhedsbrev.
Ja tak, jeg vil gerne modtage Experimentariums nyhedsbrev.
Jeg er over 18 år og accepterer hermed, at Experimentarium må kontakte mig med tilbud, information, konkurrencer og events via e-mail og sms og at Experimentarium må spørge mig, om jeg ønsker at opdatere mit samtykke. Læs hele samtykkeerklæringen her.


